
头孢哌酮/他唑巴坦复方制剂的人体药代动力学研究
马瑞蓉 张慧琳 魏敏吉 赵彩云 侯杰 赵东方
(北京大学第一医院国家药品临床研究基地,北京100034)
摘要:目的 研究静脉滴注头孢哌酮/他唑巴坦复方制剂(800mg/200mg)(海南通用三洋药业公司生产)与头孢哌酮(800mg)在健康志愿者中的药代动力学。方法 10名健康志愿者分别随机交叉静脉滴注头孢哌酮/他唑巴坦复方制剂1600mg/400mg和对照药头孢哌酮1600mg,用反相高效液相色谱法分别测定头孢哌酮和他唑巴坦血药浓度和尿中的药物浓度,计算两药的药代动力学参数,比较复方制剂两组分有无药代动力学的相互作用。
结果 试验药和参比药中头孢哌酮的血药峰浓度Cmax分别为(181.52±39.94)、(176.21±32.66) mg/L;消除半衰期t1/2β分别为(2.23±0.67)、(2.28±0.61)h;药时曲线下面积AUC0.5-12分别为(351.96±54. 53)、(336.31±54.93)mg·h∕L, AUC0-12分别为(402.21±57.6)、 (376.64±55.18)mg·h∕L,AUC0-inf分别为(413.47±59.06)、(395.83±62.08)mg·h∕L;24h尿药累积排泄百分率分别为(22.92±7.79)%、(21.00±7.33)%。他唑巴坦的峰浓度Cmax为(20.31±4.76)mg∕L,药时曲线下面积AUC0.5-5为(12.96±2.40)mg·h∕L,AUC0-5为(18.45±3.52)mg·h∕L,AUC0-inf为(19.42±3.67)mg·h∕L:消除半衰期t1/2β为(0.84±0.28)h;24h尿药累积排泄百分率为(60.56±19.37)%。结论 两种制剂中,头孢哌酮的主要药代动力学参数Cmax、t1/2β及AUC经双单侧检验无显著性差异(P>0.05),他唑巴坦的药代动力学参数Cmax、t1/2β及AUC与文献数据,比较接近,说明两组分无药代动力学的相互作用。
关键词: 头孢哌酮; 他唑巴坦; 药代动力学; 高效液相色谱法
注射用头孢哌酮钠/他唑巴坦钠(4:1) (CPZ∕TB)为一新型复方广谱抗生素(海南通用三洋药业公司生产),头孢哌酮通过抑制细菌细胞壁合成达到杀菌作用,具有抗菌谱广、作用强、对铜绿假单胞菌有强大抗菌作用等特点。但由于其对β-内酰胺酶的不稳定性以及临床产酶耐药菌的增多,广谱酶、超广谱酶的不断发展,疗效开始下降,使用受到限制,他唑巴坦是典型的不可逆β-内酰胺酶抑制剂,抑酶作用强于舒巴坦,对克拉维酸和舒巴坦无效的β-内酰胺C类酶(头孢类耐药菌株产生)有效。体内外抗菌活性试验表明,头孢哌酮钠与他唑巴坦钠配伍,重量比分别为l :l 、2 :1 、4 :1 、8 :l ,可不同程度地提高头孢哌酮单用的体外抗菌活性,l :1、2 :1、4 :1协同增效作用优于8 :1、4 :1复方对所测产酶菌的MBC50是MIC50值的2~4倍。头孢哌酮钠/他唑巴坦钠4:l配比组方,既可保持显著的协同增效作用,又可相对减少他唑巴坦用量,有利于产品对严重感染的高剂量用药,且可相对降低成本。
头孢哌酮钠和他唑巴坦钠复方制剂的人体药代动力学研究至今在国内外无相关报道。本文旨在考察头孢哌酮/他唑巴坦复方制剂(4:1)与头孢哌酮钠单方制剂中头孢哌酮和他唑巴坦的药代动力学特征,了解二者合用有无药代动力学的相互影响。
1、材料与方法
1.1药品与试剂
试验药品 头孢哌酮800mg∕他唑巴坦200mg,(CPZ∕TB)批号:20011101,失效期:2003-10-30,海南通用三洋药业有限公司生产。
参比药品 头孢哌酮(800mg ,CPZ),批号:20020101,失效期:2004-01,海南通用三洋药业有限公司生产。
标准药品 头孢哌酮为白色粉末,效价:94.4%,批号:0420-9903,中国药品生物制品检定所提供;他唑巴坦(TB)为白色粉末,效价:97.4% ,海南通用三洋药业有限公司生产。
乙腈 色谱纯Caledon Laboratories Ltd.Georgetown,Ont,Canada LTG 4R9;甲醇(北京化工厂)、高氯酸(北京南尚乐化工厂)、磷酸氢二钠(北京化工厂)、乙酸胺(北京化学试剂公司)、冰乙酸(北京化工厂)均为分析纯。
试验中各种溶液的配制均使用双蒸馏水。
1.2仪器设备
Agilent 1100 Series高效液相色谱仪,美国Agilent公司,包括:G1310AHPLC单元泵,G1313A自动进样器,G1313A紫外可调波长检测器,恒速静脉输液泵,德国B·Braun公司;–20℃低温冰箱,日本三洋公司;SHIMADZU AY120电子天平,日本岛津制作所;雷磁PHS-3C精密pH计,上海雷磁仪器厂;BFX5-30离心机,北京白洋离心机厂;KQ-50B型超声波清洗器,江苏昆山超声仪器有限公司。
1.3受试者的选择及试验方法
受试者的选择 志愿者均为男性健康志愿者,年龄20~30岁,体重在标准体重的20%之内,试验前查体、肝肾功能及试验相关各项检查检测正常,各受试者均自愿参加并在试验前由本人签署书面知情同意书。
凡有下列情况之一者均列为排除对象 健康检查不符合受试者标准;经常用药、嗜酒;3个月内用过己知对某脏器有损害的药物;有药物过敏史,特别是头孢菌素类抗菌药物过敏者;3d内有发热疾病;入选前2周内服用任何可能影响试验结果的药物,如抗生素、非类固醇类抗炎药、含铝或镁的抗酸药、利尿剂、抗凝剂及中枢神经系统抑制剂;近3个月内参加过其他研究药物的试验;筛选前3个月内献血达360ml或以上;研究者认为任何不适宜受试者进入本项试验的其它因素。
试验方法 受试者按标准体重指数编号后,随机分为二组,按双交叉法静脉滴注CPZ∕TB(头孢哌酮/他唑巴坦)1600mg∕400mg或头孢哌酮(CPZ)1600mg。两次交叉试验间隔一周。
样本采集 受试者于服药前一天吃清淡晚餐后禁食12h,受试当天早晨给药后继续禁食4h,分别在给药后4、10h进食标准餐,受试期间可以饮水,不能饮茶、咖啡及其它饮料。受试者在试验期间只能在专门病房活动,不能进行剧烈活动。试验期间不能饮酒、吸烟。所有受试者在一周内不能服用任何药物。头孢哌酮钠/他唑巴坦钠、头孢哌酮钠用生理盐水溶解后,加入100ml生理盐水中,恒速静脉点滴30min。试验期间采血安排为给药前、点滴期间的15min、点滴30min结束的即刻以及给药后的15、30、45、60、90、120、180、240、360、480、720min ,取静脉血5ml ,同时收集0~2、2~4、4~8、8~12、12~24h的尿样,计总体积后留取部分尿样于–20℃保存。离心分离血清,给药后的血标本立即测定,没有测完的标本于-20℃保存,并在样品的稳定期内测定完毕。
1.4样品测定及方法学考察
1.4.1头孢哌酮血样本
(1)头孢哌酮血样本的HPLC法条件 固定相:Alltech C18柱(150mm×4.6mm ,5um),检测波长:230nm,流动相:乙腈–0.025mol∕L乙酸胺=16:84,冰乙酸调节PH5.2。
样本处理方法 取血清标本400ul,加入800 ul 0.25%高氯酸/甲醇溶液,震荡混匀后,3000r∕min离心l0min。取上清液自动进样进行HPLC分析。
(2)方法学考察
专属性、线性范围及定量限:空白血清加入适量的头孢哌酮标准品制成不同浓度的样品,按样品处理方法处理后进行测定,样品峰处无干扰。在血清中头孢哌酮在0.31~320mg∕L的测定范围内呈现良好的线性,线性方程为:A=12.13C+14.78(r=0.9999)。以标准曲线最低浓度为最低检测限,血清中头孢哌酮的最低定量限为0.3125mg∕L。
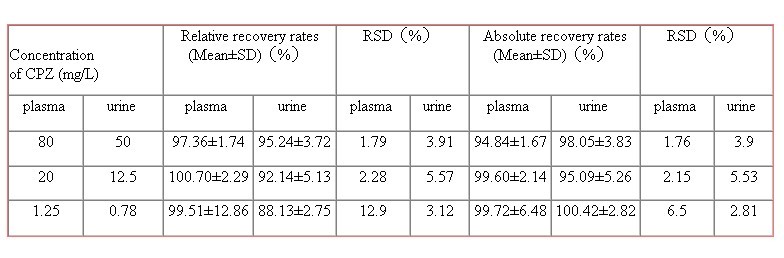
回收率及日间差与日内差:血清中80、20、1.25mg∕L三个浓度的样品溶液相对同收率和绝对回收率见Tab.1,日内和日间RSD见Tab.2。
稳定性及质控:样本在–20℃保存1周内稳定,反复冻融两次是稳定,处理后的样本在室温放置3h稳定。
1.4.2尿标本中头孢哌酮的测定
(1)头孢哌酮尿样本的HPLC法条件 固定相:Alltech C18柱(150mm×4.6mm,5um),检测波长:230nm。流动相:乙腈–0.025mol/L乙酸胺=14:86,冰乙酸调节PH5.2。
样本处理方法 取尿液标本,3000r∕min离心l0min。依据尿标本浓度高低,分别稀释5~30倍,取稀释尿液标本进自动进样进行HPLC分析。
(2)方法学考察
专属性、线性范围及定量限 空白:尿液同法处理后,样品峰处无干扰。头孢哌酮在0.39~200mg∕L的测定范围内采用加权回归,权重为1∕y2,呈现良好的线性,线性方程为:A=24. 68C+1.88(r=0. 9997)。以标准曲线最低浓度为最低检测限,尿液中头孢哌酮的最低定量限为0.39mg∕L。
回收率与日间差与日内差:血清中头孢哌酮50、12.5、0.78mg∕L三个浓度的样品溶液相对回收率和绝对回收率见Tab.1,日内、日间变异见Tab.2。
稳定性及质控:样本在-20℃保存l周内稳定,反复冻融两次是稳定的,处理后的样本在室温放置24h稳定。
1.4.3他唑巴坦血样本的HPLC法测定
(1)他唑巴坦血样本的HPLC法条件 固定相:Alltima Cl8 (5um,150mm×4.6mm),检测波长:210nm,流动相:乙腈-0.05mol∕L磷酸氢二钠溶液=2.98,磷酸调节PH6.5。
样本处理方法 取血清标本400ul,加入5%高氯酸溶液200ul,震荡混匀后,3000r∕min离心分离10min。取上清液自动进样进行HPLC分析。
(2)方法学考察
专属性、线性范围及定量限:空白血清同法处理后,样品峰处无干扰。全血中他唑巴坦在0.195~25mg/L的测定范围内呈现良好的线性,线性方程为:A=15.5532C+1.8100 (r=0.9999)。以标准曲线最低浓度为最低检测限,血清中他唑巴坦的测定最低定量限为0.195mg/L。
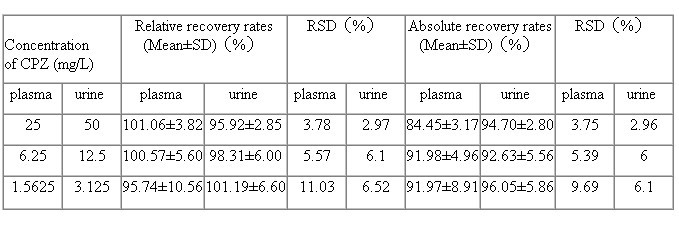
回收率与日间差与日内差:他唑巴坦25、6.25、1.56mg∕L三个浓度的样品溶液相对回收率和绝对回收率见Tab.3,日内、日间异见Tab.4。
稳定性及质控:样本在-20℃保存1周内稳定,反复冻融两次稳定,处理后的样本在室温放置5h稳定。
1.4.4尿标本中他唑巴坦的测定
(1)他唑巴坦尿样本的HPLC法条件 固定相:Alltima C18(5um,150mm×4.6mm),检测波长:220nm,流动相:乙腈-0.05mol∕L 磷酸氢二钠溶液=2:98,磷酸调节PH6.5。
样本处理方法 取尿液标本,3000r∕min离心分离l0min。依据尿标本浓度高低,分别稀释10~40倍,取稀释尿液标本进自动进样进行HPLC分析。
(2)方法学考察
专属性、线性范围及定量限:尿液同法处理后,样品峰处无干扰。他唑巴坦在0.78~l00mg∕L的例定范围内呈现良好的线性,线性方程为:A=11.1398C+2.4265(r=0.9999)。以标准曲线最低浓度为最低检测限,尿液中他唑巴坦的最低定量限为0.78mg∕L。
回收率与日间差与日内差50、12.5、3.125mg∕L三个浓度的样品溶液相对回收率和绝对回收率见Tab.3,日内、日间变异见Tab.4。
Tab.1 Recovery rates of cefoperazone in plasma and urine by HPLC(n=5)
Tab.2 The precision of cefoperazone assay method in blood and urine (n=5)
parameters |
Concentration of |
Mean Conc. of |
SD (mg/L) |
RSD (%) |
||||
|
plasma |
urine |
plasma |
urine |
plasma |
urine |
plasma |
urine |
|
|
Within-day |
80 |
50 |
77.88 |
47.62 |
1.39 |
1.86 |
1.79 |
3.91 |
|
20 |
12.5 |
20.14 |
11.52 |
0.46 |
0.64 |
2.28 |
5.57 |
|
|
1.25 |
0.78 |
1.24 |
0.69 |
0.16 |
0.02 |
12.92 |
3.12 |
|
|
Between-days |
80 |
50 |
77.19 |
44.66 |
2.43 |
1.4 |
3.14 |
3.13 |
|
20 |
12.5 |
19.28 |
11.78 |
1.1 |
0.45 |
5.71 |
3.82 |
|
|
1.25 |
0.78 |
1.22 |
0.76 |
0.15 |
0.04 |
12.12 |
4.69 |
|
Tab.3 Recovery rates of tazobactam in plasma and urine by HPLC (n=5)
Tab.4 The precision of tazobactam assay method in blood and urine (n=5)
parameters |
Concentration of |
Mean Conc. of |
SD (mg/L) |
RSD (%) |
||||
|
plasma |
urine |
plasma |
urine |
plasma |
urine |
plasma |
urine |
|
|
Within-day |
25 |
50 |
25.26 |
47.96 |
0.95 |
1.42 |
3.78 |
2.97 |
|
6.25 |
12.5 |
6.29 |
12.29 |
0.35 |
0.75 |
5.57 |
6.1 |
|
|
1.5625 |
3.125 |
1.5 |
3.16 |
0.16 |
0.21 |
11.03 |
6.52 |
|
|
Between-days |
25 |
50 |
25.46 |
47.41 |
0.84 |
1.34 |
3.28 |
2.84 |
|
6.25 |
12.56 |
6.67 |
11.26 |
0.4 |
0.22 |
5.93 |
1.96 |
|
|
1.5625 |
3.125 |
1.61 |
3.14 |
0.16 |
0.28 |
9.74 |
8.88 |
|
稳定性及质控 样本在-20℃保存l周内稳定,反复冻融两次稳定,处理后的样本在室温放置5h稳定。
1.5数据处理
药代动力学计算采用3P97软件进行拟合计算,计算过程按最佳拟合选择模型。用Excel对主要药代动力学参数进行配对t检验。Cmax为实测值,AUC0.5-n为静脉滴注结束到最后采血点之间的血药浓度曲线下面积,为梯形法计算值。
2、结果
2.1受试者一般情况
10名完成实验的志愿者均为健康男性,大学在校学生,平均年龄为(22.60±1.17)岁,身高(172.70±4.69)cm,体重(65.15±4.34)kg,体重指数BMI(21.84±1.13),体检、心电图、血生化、血常规和尿常规试验前均为正常。
2.2血药浓度测定及药代动力学参数结果
2.2.1头孢哌酮血药浓度测定及药代动力学参数结果
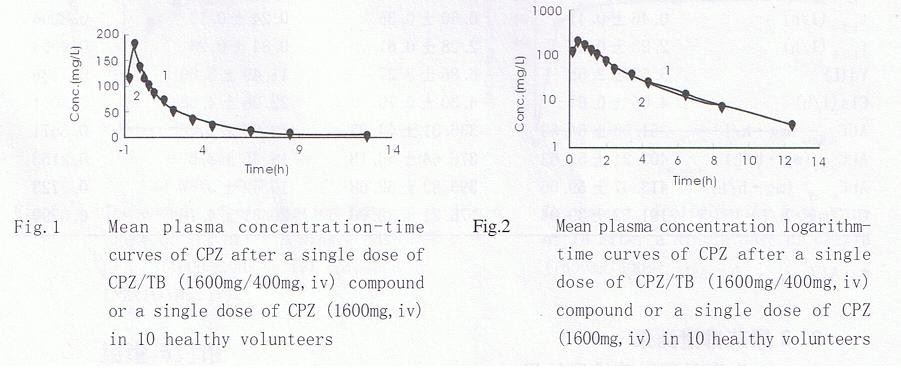
(1)血药浓度测定结果 试验药CPZ∕TB与对照药CPZ滴注后CPZ达峰浓度Cmax分别为(181.52±41.66)、(176.21±32.66)mg∕L;药时曲线下面积AUC0.5-12分别为(351.96±54.5)、(336.31±54.93)mg·h∕L,AUC0-12分别为(402.21±57.6)、(376.64±55.18)mg·h∕L, AUC0-inf分别为(413.47±59.0)、(395.83±62.08)mg·h∕L。平均血药浓度一时间曲线见Fig.1,平均对数血药浓度一时间曲线见Fig.2。
(2)药代动力学计算结果及统计分析 用3P97程序对试验药CPZ∕TB和参比药CPZ进行房室模型模拟,确认最佳房室模型为二房室,权重W=1∕C。10名受试者的主要药代动力学参数见Tab.5,t1/2β、AUC、Cmax、C1r、Vd经配对t检验无显著性差异(P>0.05)。对头孢哌酮在两个实验周期中的AUC0-∞进行方差分析,结果表明两周期间头孢哌酮AUC0-∞没有显著性差异((P>0.05)。
2.2.2他唑巴坦血药浓度测定及药代动力学参数结果
(1)单次静脉滴注CPZ∕TAZ后他唑巴坦血药浓度
他唑巴坦达峰浓度Cmax为(20.31±4.76)mg∕L,AUC0.5-5为(12.96±2.40)mg·h∕L, AUC0-5为(18.45±3.52)mg·h∕L, AUC0-inf为(19.42±3.67)mg·h∕L。血药浓度一时间曲线见Fig.3,血药浓度对数一时间曲线见Fig.4。
(2)他唑巴坦药代动力学参数结果
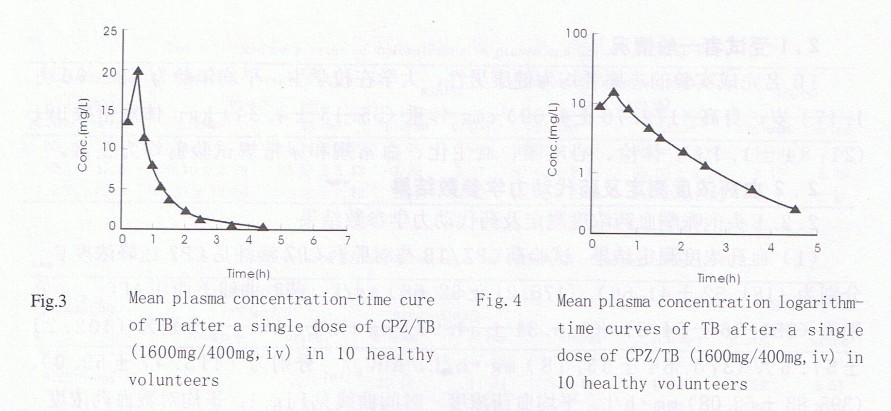
用3P97程序对试验药CPZ∕TB中他唑巴坦的药代动力学时行房室模型模拟,确认最佳房室模型为二房室,权重W=1∕C。10名受试者的主要药代动力学参数见Tab.5,试验药中他唑巴坦的AUC0-5为(18.45±3.52)mg·h∕L,消除半衰期t1/2为(0.84±0.287)h;CLs为(22.36±4.08)1∕h,Vd为(11.49±5.60)L。
Tab.5 Pharmacokinetics parameters of CPZ and TB in volunteers after a single
dose of CPZ∕TB(1600mg∕400mg,iv)compound or CPZ(1600mg,iv)
Parameters |
CPZ∕TB |
CPZ |
TB |
t-test﹡ |
|
A(mg∕L) |
181.24±136.81 |
188.49±144.67 |
18.67±11.62 |
0.9310 |
|
α(1∕h) |
3.44±2.77 |
5.47±10.12 |
6.39±8.94 |
0.5861 |
|
B(mg∕L) |
623.19±196.99 |
576.79±222.50 |
18.23±10.25 |
0.6459 |
|
β(1∕h) |
0.33±0.09 |
0.33±0.10 |
0.90±0.28 |
0.8888 |
|
K21(1∕h) |
1.61±1.22 |
1.54±1.72 |
1.93±1.36 |
0.9342 |
|
K10(1∕h) |
0.71±0.28 |
0.91±0.93 |
2.61±2.23 |
0.5161 |
|
K12(1∕h) |
1.45±1.46 |
3.34±7.73 |
2.76±5.73 |
0.4887 |
|
t1/2α(1∕h) |
0.46±0.41 |
0.50±0.35 |
0.24±0.17 |
0.8204 |
|
t1/2β(1∕h) |
2.23±0.67 |
2.28±0.61 |
0.84±0.28 |
0.9004 |
|
Vd(L) |
6.52±2.55 |
6.86±3.27 |
11.49±5.60 |
0.7739 |
|
Cls(1∕h) |
4.06±0.61 |
4.30±0.79 |
22.36±4.08 |
0.3061 |
|
AUC0.5-12(mg·h∕L) |
351.96±54.53 |
336.31±54.93 |
12.96±2.40﹡ |
0.3571 |
|
AUC0-12(mg·h∕L) |
402.21±57.63 |
376.64±55.18 |
18.45±3.52△ |
0.2153 |
|
AUC0-inf(mg·h∕L) |
413.47±59.06 |
395.83±62.08 |
19.42±3.67 |
0.3723 |
|
Cmax(mg·h∕L) |
181.52±39.94 |
176.21±32.66 |
20.31±4.76 |
0.6790 |
﹡:AUC0.5-5;△:AUC0.5-5。
2.3 尿药排泄结果
2.3.1 头孢哌酮尿药排泄结果
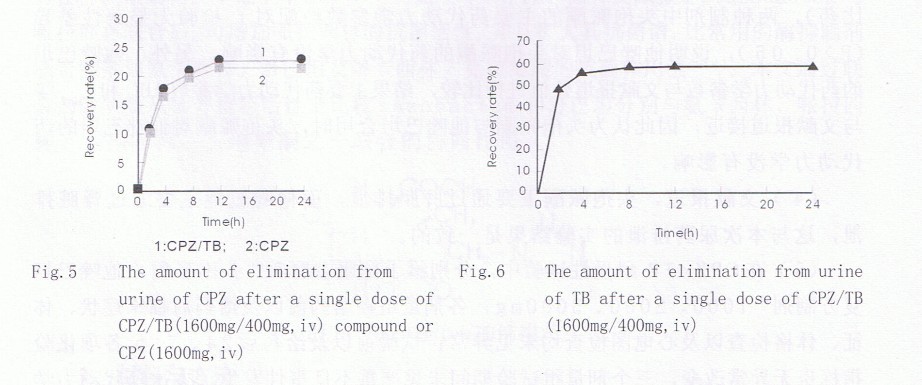
10名健康受试者静脉滴注CPZ∕TB和CPZ 24h后原型药物在尿中累积排泄量分别为(366.7±118.23)、(335.9±111.31)mg;累计排泄百分率分别为(22.92±7.79)%、(21.00±7.33)%,给药后0~2、2~4、4~8、8~12、12~24h尿中药物的浓度、排泄量、排泄百分率结果见Tab.6。
2.3.2他唑巴坦尿药排泄结果
10名健康受试者静脉滴注CPZ∕TB 24h后原型药物在尿中累计排泄百分率为(60.56±19.37)%,结果见Tab.7。
Tab.6 Concentration of CPZ in urine after a single dose of CPZ(1600mg iv)
and CPZ∕TB (1600mg∕400mg,iv)
Time (h) |
Concentration of CPZ(mg∕L) |
Amount of elimination(mg) |
Recovery rate(%) |
|||
|
CPZ∕TB |
CPZ |
CPZ∕TB |
CPZ |
CPZ∕TB |
CPZ |
|
|
0~2 |
35.73±37.98 |
42.59±57.68 |
180.46±49.44 |
173.10±82.95 |
11.28±3.09 |
10.82±5.18 |
|
2~4 |
15.20±13.52 |
26.14±34.41 |
108.31±107.31 |
96.11±62.27 |
18.05±5.75 |
16.83±5.24 |
|
4~8 |
6.23±9.11 |
13.66±18.56 |
45.26±48.81 |
48.07±34.57 |
20.88±7.29 |
19.83±6.57 |
|
8~12 |
7.10±7.24 |
4.14±5.25 |
24.95±30.02 |
11.77±9.96 |
22.44±7.48 |
20.57±7.02 |
|
12~24 |
1.36±1.26 |
1.34±1.98 |
7.68±8.32 |
6.89±7.60 |
22.92±7.79 |
21.00±7.33 |
Tab.7 Concentration of TB in urine after a single dose of CPZ∕TB (1600mg∕400mg,iv)
Time(h) |
Concentration of TB(mg∕L) |
Amount of elimination(mg) |
Recovery rate(%) |
|
0~2 |
34.37±35.14 |
197.18±79.80 |
49.30±19.95 |
|
2~4 |
4.36±3.99 |
31.85±27.45 |
57.26±19.11 |
|
4~8 |
1.72±0.69 |
12.57±7.95 |
60.09±19.22 |
|
8~12 |
1.77±0.15 |
6.47±6.06 |
60.56±19.37 |
|
12~24 |
LOQ |
LOQ |
60.56±19.37 |
3、结论与讨论
(1)据报道,头孢哌酮的血药峰浓度和药时曲线下面积与剂量成正比。15min内静脉滴注2g头孢哌酮后的峰浓度为253ug∕ml,随着给药间隔时间的长短不同,峰浓度可从202至375ug∕ml。给药时间短,则峰浓度高。静脉滴注12h后血药浓度平均为1.9~2.4ug∕ml,报道头孢哌酮的消除半衰期为1.6~2.6h,尿药回收率为给药剂量的15%~36%,随着剂量增加,尿药排泄稍有增加。本文研究结果头孢哌酮∕他唑巴坦和参比药头孢哌酮的峰浓度Cmax分别为(181.52±39.94)、(176.21±32.66)mg∕L;消除半衰期t1/2β分别为(2.23±0.67)、(2.28±0.61)h;药时曲线下面积AUC0.5-12分别为(351.96±54.53)、(336.31±54.93)mg·h∕L, AUC0-12分别为(402.21±57.63)、(376.64±55.18)mg·h∕L, AUC0-inf分别为(413.47±59.06)、(395.83±62.08) mg·h∕L; 24h尿药累积排泄百分率分别为(22.92±7.79)%、(21.00±7.33)%,与文献报道相一致。
(2)他唑巴坦单独用药,给予健康志愿者后,由肾排泄的原型药物由0.1g时的60.3%到1.0g对的77.0%。他唑巴坦的消除半衰期在单剂量或多剂量给予0.1~1.0g(30min滴注)后,半衰期为0.35~0.63h。另外一篇报道在静脉给予他唑巴坦500mg后,平均半衰期为(1.1±0.2)h(0.9~1.2h)。Curtis等报道正常健康志愿者在给予0.375g他唑巴坦和3g哌拉西林后的他唑巴坦t1/2β为0.89h。健康志愿者在30min内静脉给予0.5g他唑巴坦,Cmax为23.5或27.1mg∕L,AUC0-∞为23.5或27.1mg·h∕L。本文研究结果健康志愿者给予头孢哌酮∕他唑巴坦复合物(含他唑巴坦0.4g),他唑巴坦的峰浓度Cmax为(20.31±4.76)mg∕L,药时曲线下面积AUC0.5-5为(12.96±2.40)mg·h∕L,AUC0-5为(18.45±3.52)mg·h∕L,AUC0-inf为(19.42±3.67)mg·h∕L;消除半衰期t1/2β为(0.84±0.28)h;Vd为(11.49±5.60)L,24h尿药累积排泄百分率为(60.56±19.37)%,与文献报道接近。
(3)本试验10名志愿者静脉滴注CPZ∕TB(4:1,试验药)与头孢哌酮(参比药),两种制剂中头孢哌酮的主要药代动力学参数经配对t检验无显著性差异(P>0.05),说明他唑巴坦对头孢哌酮的药代动力学没有影响。另外,他唑巴坦的药代动力学参数与文献报道数值进行比较,结果主要药代动力学参数AUC和Cmax等与文献报道接近,因此认为头孢哌酮与他唑巴坦合用时,头孢哌酮对他唑巴坦的药代动力学没有影响。
(4)文献报道,头孢哌酮主要通过肝胆排泄,而他唑巴坦主要通过肾脏排泄,这与本次尿药排泄的实验结果是一致的。
(5)在CPZ∕TB耐受性试验中,分别给予健康志愿者“头孢哌酮∕他唑巴坦复方制剂”1000、2000、3000mg,各剂量组在给药前以及给药后临床症状、体征、体格检查以及心电图检查均未见异常;试验前以及给药后24、72h各项化验指标也无异常改变,三个剂量组试验期间未见严重不良事件发生。本次药代动力学试验期间,10例受试者中无一例因不良反应终止试验,全部受试者的血液、血液生化、尿分析及心电图检查均未见有临床意义的异常,临床检查时也未发现由试验药引起的异常变化,药物在试验剂量下表现出良好的安全性。